PRP moderno: “PRP clínico”
En los últimos 10 años, el esquema de tratamiento del PRP ha sufrido grandes cambios.Gracias a la investigación experimental y clínica, ahora tenemos una mejor comprensión de la fisiología de las plaquetas y otras células.Además, varias evaluaciones sistemáticas de alta calidad, metanálisis y ensayos controlados aleatorios han demostrado la eficacia de la biotecnología del PRP en muchos campos médicos, incluidos la dermatología, la cirugía cardíaca, la cirugía plástica, la cirugía ortopédica, el tratamiento del dolor, las enfermedades de la columna y la medicina deportiva. .
La característica actual del PRP es su concentración absoluta de plaquetas, que cambia desde la definición inicial de PRP (incluida la concentración de plaquetas superior al valor inicial) a más de 1 × 10 6/μ L o aproximadamente 5 veces la concentración mínima de plaquetas en plaquetas de base.En la extensa revisión de Fadadu et al.Se evaluaron 33 sistemas y protocolos de PRP.El recuento de plaquetas de la preparación final de PRP producida por algunos de estos sistemas es inferior al de la sangre total.Informaron que el factor plaquetario del PRP aumentó hasta 0,52 con el kit de giro único (Selphyl ®).Por el contrario, EmCyte Genesis PurePRPII ® de doble rotación La concentración de plaquetas producida por el dispositivo es la más alta (1,6 × 10 6 /μL).
Obviamente, los métodos in vitro y animales no son el entorno de investigación ideal para una transformación exitosa en la práctica clínica.Del mismo modo, el estudio de comparación de dispositivos no respalda la decisión, porque muestra que la concentración de plaquetas entre dispositivos de PRP es muy diferente.Afortunadamente, a través de la tecnología y el análisis basados en la proteómica, podemos aumentar nuestra comprensión de las funciones celulares en el PRP que afectan los resultados del tratamiento.Antes de llegar a un consenso sobre preparaciones y formulaciones estandarizadas de PRP, el PRP debe seguir las formulaciones clínicas de PRP para promover mecanismos sustanciales de reparación de tejidos y resultados clínicos progresivos.
Fórmula clínica de PRP
En la actualidad, el PRP clínico eficaz (C-PRP) se ha caracterizado como una composición compleja de componentes multicelulares autólogos en plasma de pequeño volumen obtenido de una parte de sangre periférica tras centrifugación.Después de la centrifugación, el PRP y sus componentes celulares no plaquetarios se pueden recuperar del dispositivo de concentración según diferentes densidades celulares (de las cuales la densidad de plaquetas es la más baja).
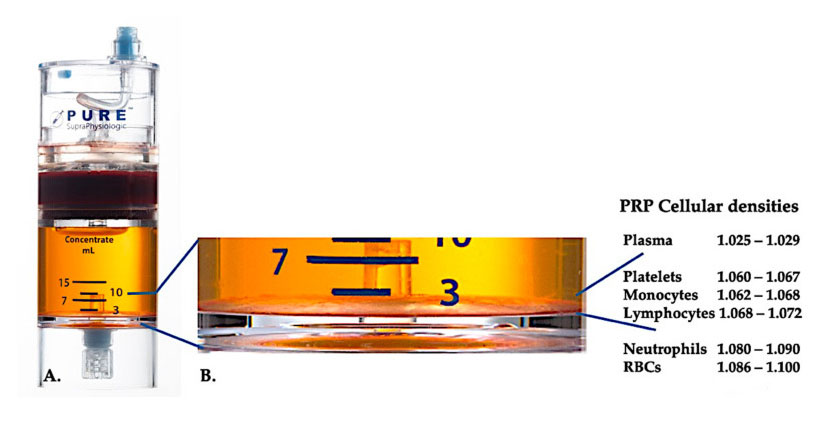
Utilice un equipo de separación de densidad celular PurePRP-SP ® (EmCyte Corporation, Fort Myers, FL, EE. UU.) para sangre completa después de dos procedimientos de centrifugación.Después del primer proceso de centrifugación, el componente sanguíneo total se separó en dos capas básicas, suspensión de plasma de plaquetas (magras) y capa de glóbulos rojos.En A, se ha completado el segundo paso de centrifugación.El volumen real de PRP se puede extraer para su aplicación al paciente.La ampliación en B muestra que hay una capa marrón de sedimentación globular multicomponente organizada (representada por la línea azul) en la parte inferior del equipo, que contiene altas concentraciones de plaquetas, monocitos y linfocitos, según el gradiente de densidad.En este ejemplo, según el protocolo de preparación de C-PRP con neutrófilos pobres, se extraerá el porcentaje mínimo de neutrófilos (<0,3%) y eritrocitos (<0,1%).
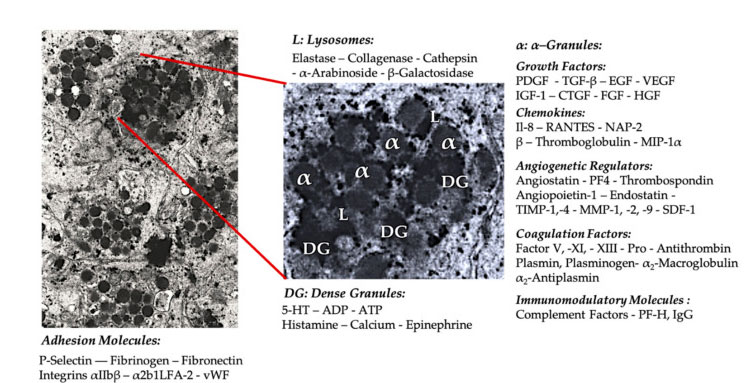
Gránulo de plaquetas
En las primeras aplicaciones clínicas del PRP, los gránulos α son la estructura interna plaquetaria citada con más frecuencia, porque contienen factores de coagulación, una gran cantidad de PDGF y reguladores angiogénicos, pero tienen poca función trombogénica.Otros factores incluyen componentes de quimiocinas y citocinas menos conocidos, como el factor plaquetario 4 (PF4), la proteína básica preplaquetaria, la selectina P (un activador de la integrina) y la quimiocina RANTES (regulada por activación, que expresa células T normales y presumiblemente secretando).La función general de estos componentes específicos de los gránulos plaquetarios es reclutar y activar otras células inmunes o inducir inflamación de las células endoteliales.
Los componentes granulares densos como el ADP, la serotonina, el polifosfato, la histamina y la adrenalina se utilizan más implícitamente como reguladores de la activación plaquetaria y la trombosis.Lo más importante es que muchos de estos elementos tienen la función de modificar las células inmunitarias.El ADP plaquetario es reconocido por el receptor P2Y12ADP en las células dendríticas (DC), aumentando así la endocitosis del antígeno.Las DC (células presentadoras de antígenos) son muy importantes para iniciar la respuesta inmunitaria de las células T y controlar la respuesta inmunitaria protectora, que vincula el sistema inmunitario innato y el sistema inmunitario adaptativo.Además, el trifosfato de adenosina (ATP) plaquetario envía señales a través del receptor de células T P2X7, lo que lleva a una mayor diferenciación de las células T auxiliares CD4 en células T auxiliares 17 (Th17) proinflamatorias.Otros componentes granulares densos en plaquetas (como el glutamato y la serotonina) inducen la migración de células T y aumentan la diferenciación de monocitos a CD, respectivamente.En el PRP, estos inmunomoduladores derivados de partículas densas están altamente enriquecidos y tienen funciones inmunes sustanciales.
El número de interacciones potenciales directas e indirectas entre las plaquetas y otras células (receptoras) es amplio.Por lo tanto, la aplicación de PRP en el entorno del tejido patológico local puede inducir una variedad de efectos inflamatorios.
Concentración de plaquetas
El C-PRP debe contener dosis clínicas de plaquetas concentradas para producir efectos terapéuticos beneficiosos.Las plaquetas en C-PRP deberían estimular la proliferación celular, la síntesis de factores mesenquimales y neurotróficos, promover la migración de células quimiotácticas y estimular la actividad inmunorreguladora, como se muestra en la figura.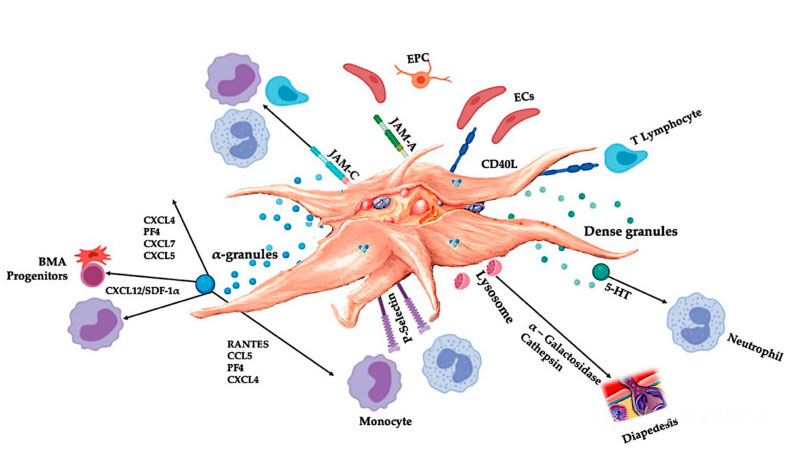
Las plaquetas activadas, la liberación de PGF y las moléculas de adhesión median en una variedad de interacciones celulares: quimiotaxis, adhesión celular, migración y diferenciación celular, y regulan las actividades reguladoras inmunitarias.Estas interacciones entre células plaquetarias contribuyen a la angiogénesis y la actividad inflamatoria y, en última instancia, estimulan el proceso de reparación del tejido.Abreviaturas: BMA: aspirado de médula ósea, EPC: células progenitoras endoteliales, EC: células endoteliales, 5-HT: 5-hidroxitriptamina, RANTES: regulación activada de la expresión normal de células T y supuesta secreción, JAM: tipo de molécula de adhesión de unión, CD40L: grupo 40 ligando, SDF-1 α: factor 1 α derivado de células estromales, CXCL: ligando de quimiocina (motivo CXC), PF4: factor plaquetario 4. Adaptado de Everts et al.
Marx fue la primera persona en demostrar que se mejoraba la curación de huesos y tejidos blandos, y que el recuento mínimo de plaquetas era 1 × 10 6 /μL. Estos resultados se confirmaron en un estudio de fusión lumbar a través del agujero intervertebral, cuando la dosis de plaquetas era mayor que 1,3 × A 106 plaquetas/μ L, este estudio demostró más fusión.Además, Giusti et al.Revelado 1,5 × El mecanismo de reparación de tejidos a una dosis de 109 requiere plaquetas/mL para inducir la angiogénesis funcional a través de la actividad de las células endoteliales.En el último estudio, concentraciones más altas redujeron el potencial de angiogénesis de las plaquetas dentro y alrededor de los folículos.Además, datos anteriores mostraron que la dosis de PRP también afectaría los resultados del tratamiento.Por lo tanto, para inducir significativamente la reacción de angiogénesis y estimular la proliferación y migración celular, C-PRP debe contener al menos 7,5 en una botella de tratamiento de PRP de 5 ml × 10 9 que puedan administrar plaquetas.
Además de la dependencia de la dosis, el efecto del PRP sobre la actividad celular parece depender en gran medida del tiempo.Sofía y col.Estos resultados sugieren que la exposición a corto plazo a lisados de plaquetas humanas puede estimular la proliferación de células óseas y la quimiotaxis.Por el contrario, la exposición prolongada al PRP conducirá a niveles más bajos de fosfatasa alcalina y formación de minerales.
glóbulo rojo
Los glóbulos rojos son responsables de transportar oxígeno a los tejidos y transferir dióxido de carbono de los tejidos a los pulmones.No tienen núcleo y están compuestos por moléculas hemo que se unen a proteínas.Los componentes de hierro y hemo de los glóbulos rojos promueven la combinación de oxígeno y dióxido de carbono.Generalmente, el ciclo de vida de los glóbulos rojos es de unos 120 días.Los macrófagos los eliminan de la circulación mediante un proceso llamado envejecimiento de los glóbulos rojos.Los glóbulos rojos en muestras de PRP pueden dañarse en condiciones de cizallamiento (por ejemplo, cirugía de hemorragia total, proceso inmunomediado, estrés oxidativo o esquema de concentración de PRP inadecuado).Por lo tanto, la membrana celular de los glóbulos rojos se descompone y libera hemoglobina tóxica (Hb), medida por hemoglobina libre en plasma (PFH), hemo y hierro.].El PFH y sus productos de degradación (hemo y hierro) producen conjuntamente efectos nocivos y citotóxicos en los tejidos, provocando estrés oxidativo, pérdida de óxido nítrico, activación de vías inflamatorias e inmunosupresión.Estos efectos eventualmente conducirán a disfunción de la microcirculación, vasoconstricción local y lesión vascular, así como daño tisular grave.
Lo más importante es que cuando los glóbulos rojos que contienen C-PRP se administran al tejido, provocarán una reacción local llamada eriptosis, que desencadenará la liberación de una citoquina eficaz y un inhibidor de la migración de macrófagos.Esta citoquina inhibe la migración de monocitos y macrófagos.Ejerce fuertes señales proinflamatorias a los tejidos circundantes, inhibe la migración de células madre y la proliferación de fibroblastos y conduce a una importante disfunción celular local.Por lo tanto, es importante limitar la contaminación por eritrocitos en las preparaciones de PRP.Además, nunca se ha determinado el papel de los glóbulos rojos en la regeneración de tejidos.Un proceso adecuado de centrifugación y preparación de C-PRP generalmente reducirá o incluso eliminará la presencia de glóbulos rojos, evitando así las consecuencias adversas de la hemólisis y la policitemia.
Leucocitos en C-PRP
La presencia de glóbulos blancos en las preparaciones de PRP depende del equipo de tratamiento y del esquema de preparación.En los equipos de PRP a base de plasma se eliminan por completo los glóbulos blancos;Sin embargo, los glóbulos blancos se concentraron significativamente en la preparación de PRP de la capa marrón de sedimentación de eritrocitos.Debido a sus mecanismos inmunológicos y de defensa del huésped, los glóbulos blancos afectan en gran medida la biología interna de las afecciones tisulares agudas y crónicas.Estas características se analizarán más adelante.Por tanto, la presencia de leucocitos específicos en C-PRP puede provocar importantes efectos celulares y tisulares.Más específicamente, diferentes sistemas de capas de sedimentación de eritrocitos de PRP de color marrón-amarillo utilizan diferentes esquemas de preparación, produciendo así diferentes proporciones de neutrófilos, linfocitos y monocitos en PRP.Los eosinófilos y basófilos no se pueden medir en las preparaciones de PRP porque sus membranas celulares son demasiado frágiles para resistir las fuerzas de procesamiento centrífugas.
Neutrófilos
Los neutrófilos son leucocitos esenciales en muchas vías de curación.Estas vías se combinan con proteínas antimicrobianas presentes en las plaquetas para formar una barrera densa contra patógenos invasivos.La existencia de neutrófilos se determina según el objetivo del tratamiento con C-PRP.Es posible que se requieran mayores niveles de inflamación del tejido en la bioterapia de PRP para el cuidado de heridas crónicas o en aplicaciones destinadas al crecimiento o la curación de los huesos.Es importante destacar que se han encontrado funciones adicionales de los neutrófilos en varios modelos, lo que enfatiza su papel en la angiogénesis y la reparación de tejidos.Sin embargo, los neutrófilos también pueden tener efectos nocivos, por lo que no son adecuados para algunas aplicaciones.Zhou y Wang demostraron que el uso de PRP rico en neutrófilos puede conducir a un aumento en la proporción de colágeno tipo III con respecto al colágeno tipo I, exacerbando así la fibrosis y reduciendo la fuerza del tendón.Otras características dañinas mediadas por los neutrófilos son la liberación de citocinas inflamatorias y metaloproteinasas de matriz (MMP), que pueden promover la inflamación y el catabolismo cuando se aplican a los tejidos.
leucomonocito
En C-PRP, los linfocitos T y B mononucleares están más concentrados que cualquier otro glóbulo blanco.Están estrechamente relacionados con la inmunidad adaptativa citotóxica mediada por células.Los linfocitos pueden desencadenar reacciones celulares para combatir infecciones y adaptarse a los invasores.Además, las citocinas derivadas de los linfocitos T (interferón-γ [IFN-γ] e interleucina-4 (IL-4) mejoran la polarización de los macrófagos. Verassar et al. Está demostrado que los linfocitos T convencionales pueden promover indirectamente la curación del tejido en el modelo de ratón regulando la diferenciación de monocitos y macrófagos.
Monocito - célula reparadora multipotente
Según el dispositivo de preparación de PRP utilizado, los monocitos pueden sobresalir o no existir en el frasco de tratamiento de PRP.Desafortunadamente, su rendimiento y capacidad de regeneración rara vez se analizan en la literatura.Por tanto, se presta poca atención a los monocitos en el método de preparación o fórmula final.El grupo de monocitos es heterogéneo, se origina a partir de células progenitoras en la médula ósea y se transporta a los tejidos periféricos a través de la vía de las células madre hematopoyéticas según la estimulación del microambiente.Durante la homeostasis y la inflamación, los monocitos circulantes abandonan el torrente sanguíneo y son reclutados en tejidos lesionados o degradados.Pueden actuar como macrófagos (M Φ) como células efectoras o como células progenitoras.Los monocitos, macrófagos y células dendríticas representan el sistema fagocítico mononuclear (MPS). Una característica típica del MPS es la plasticidad de su patrón de expresión genética y la superposición funcional entre estos tipos de células.En los tejidos degenerados, los macrófagos residentes, los factores de crecimiento que actúan localmente, las citocinas proinflamatorias, las células apoptóticas o necróticas y los productos microbianos inician la diferenciación de los monocitos en grupos de células MPS.Supongamos que cuando se inyecta C-PRP que contiene monocitos de alto rendimiento en el microambiente local de la enfermedad, es probable que los monocitos se diferencien en M Φ para provocar cambios celulares importantes.
De monocito a M Φ En proceso de transformación, fenotipo M Φ específico.En los últimos diez años, se ha desarrollado un modelo que integra M Φ. El complejo mecanismo de activación se describe como polarización de dos estados opuestos: M Φ Fenotipo 1 (M Φ 1, activación clásica) y M Φ Fenotipo 2 (M Φ 2, activación alternativa).M Φ 1 se caracteriza por la secreción de citocinas inflamatorias (IFN-γ) y óxido nítrico para producir un mecanismo eficaz de eliminación de patógenos.M Φ El fenotipo también produce factor de crecimiento endotelial vascular (VEGF) y factor de crecimiento de fibroblastos (FGF).M Φ El fenotipo está compuesto por células antiinflamatorias con alta fagocitosis.M Φ 2 Produce componentes de la matriz extracelular, angiogénesis y quimiocinas, e interleucina 10 (IL-10).Además de la defensa contra patógenos, M Φ también puede reducir la inflamación y promover la reparación de tejidos.Es de destacar que M Φ 2 se ha subdividido en M in vitro Φ 2a, M Φ 2b y M Φ 2. Depende del estímulo.La traducción in vivo de estos subtipos es difícil porque el tejido puede contener grupos MΦ mixtos.Curiosamente, según las señales ambientales locales y los niveles de IL-4, el M Φ 1 proinflamatorio se puede convertir para promover la reparación M Φ 2. A partir de estos datos, es razonable suponer que existen altas concentraciones de monocitos y preparaciones de M Φ C-PRP. pueden contribuir a una mejor reparación de los tejidos porque tienen capacidades antiinflamatorias de reparación de tejidos y transducción de señales celulares.
Definición confusa de fracción de glóbulos blancos en PRP
La presencia de glóbulos blancos en los frascos de tratamiento de PRP depende del dispositivo de preparación de PRP y puede tener diferencias significativas.Existen muchas disputas sobre la existencia de leucocitos y su contribución a diferentes productos sub-PRP (como PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF y L-PRF). En una revisión reciente, seis aleatorizados Los ensayos controlados (nivel de evidencia 1) y tres estudios comparativos prospectivos (nivel de evidencia 2) involucraron a 1055 pacientes, lo que indica que LR-PRP y LP-PRP tenían una seguridad similar.El autor concluyó que la reacción adversa del PRP puede no estar directamente relacionada con la concentración de glóbulos blancos.En otro estudio, LR-PRP no cambió la interleucina inflamatoria (IL-1) en la rodilla con OA (β, IL-6, IL-8 e IL-17).Estos resultados respaldan la opinión de que el papel de los leucocitos en la actividad biológica del PRP in vivo puede provenir de la interferencia entre plaquetas y leucocitos.Esta interacción puede promover la biosíntesis de otros factores (como el lipoxígeno), que pueden compensar o promover la regresión de la inflamación.Después de la liberación inicial de moléculas inflamatorias (ácido araquidónico, leucotrienos y prostaglandinas), las plaquetas activadas liberan lipoxígeno A4 para prevenir la activación de los neutrófilos.Es en este entorno que el fenotipo M Φ de M Φ 1 cambia a M Φ 2. Además, cada vez hay más pruebas de que las células mononucleares circulantes pueden diferenciarse en una variedad de tipos de células no fagocíticas debido a su pluripotencia.
El tipo de PRP afectará la cultura de MSC.En comparación con las muestras puras de PRP o PPP, LR-PRP puede inducir una proliferación significativamente mayor de MSC derivadas de la médula ósea (BMMSC), con una liberación más rápida y una mejor actividad biológica de PGF.Todas estas características favorecen la adición de monocitos al frasco de tratamiento de PRP y el reconocimiento de su capacidad inmunomoduladora y potencial de diferenciación.
Regulación inmune congénita y adaptativa del PRP.
La función fisiológica más famosa de las plaquetas es controlar el sangrado.Se acumulan en el lugar del daño tisular y en los vasos sanguíneos dañados.Estos eventos son causados por la expresión de integrinas y selectinas que estimulan la adhesión y agregación plaquetaria.El endotelio dañado agrava aún más este proceso y el colágeno expuesto y otras proteínas de la matriz subendotelial promueven la activación profunda de las plaquetas.En estos casos se ha demostrado el importante papel de la interacción entre el factor von Willebrand (vWF) y la glicoproteína (GP), especialmente la GP-Ib.Después de la activación plaquetaria, las plaquetas α-, densas, los lisosomas y los gránulos T regulan la exocitosis y liberan su contenido al entorno extracelular.
Molécula de adhesión plaquetaria
Para comprender mejor el papel del PRP en los tejidos inflamatorios y las plaquetas en la respuesta inmune, debemos comprender cómo los diferentes receptores de la superficie de las plaquetas (integrinas), las moléculas de adhesión de unión (JAM) y las interacciones celulares pueden iniciar procesos críticos en la inmunidad innata y adaptativa.
Las integrinas son moléculas de adhesión a la superficie celular que se encuentran en varios tipos de células y se expresan en grandes cantidades en las plaquetas.Las integrinas incluyen a5b1, a6b1, a2b1 LFA-2, (GPIa/IIa) y aIIbb3 (GPIIb/IIIa).Por lo general, existen en un estado estático y de baja afinidad.Después de la activación, cambian al estado de alta afinidad de unión al ligando.Las integrinas tienen diferentes funciones sobre las plaquetas y participan en la interacción de las plaquetas con varios tipos de glóbulos blancos, células endoteliales y matriz extracelular.Además, el complejo GP-Ib-V-IX se expresa en la membrana plaquetaria y es el principal receptor para la unión con von vWF.Esta interacción media el contacto inicial entre las plaquetas y las estructuras subendoteliales expuestas.La integrina plaquetaria y el complejo GP están relacionados con diversos procesos inflamatorios y desempeñan un papel importante en la formación del complejo plaquetas-leucocitos.Específicamente, la integrina aIIbb3 es necesaria para formar un complejo estable combinando fibrinógeno con el receptor del antígeno macrófago 1 (Mac-1) en los neutrófilos.
Las plaquetas, los neutrófilos y las células endoteliales vasculares expresan moléculas de adhesión celular específicas, llamadas selectina.En condiciones inflamatorias, las plaquetas expresan selectina P y selectina L de neutrófilos.Después de la activación plaquetaria, la selectina P puede unirse al ligando PSGL-1 que existe en los neutrófilos y monocitos.Además, la unión de PSGL-1 inicia una reacción en cascada de señales intracelulares, que activa los neutrófilos a través de la integrina Mac-1 de los neutrófilos y el antígeno 1 relacionado con la función de los linfocitos (LFA-1).Mac-1 activado se une a GPIb o GPIIb/IIIa en las plaquetas a través del fibrinógeno, estabilizando así la interacción entre neutrófilos y plaquetas.Además, el LFA-1 activado puede combinarse con la molécula 2 de adhesión intercelular de plaquetas para estabilizar aún más el complejo de neutrófilos-plaquetas para promover la adhesión a largo plazo con las células.
Las plaquetas y los leucocitos desempeñan un papel clave en las respuestas inmunes innatas y adaptativas.
El cuerpo puede reconocer cuerpos extraños y tejidos lesionados en enfermedades agudas o crónicas para iniciar una reacción en cascada de curación de heridas y una vía inflamatoria.Los sistemas inmunológicos innato y adaptativo protegen al huésped de las infecciones y los glóbulos blancos desempeñan un papel importante en la superposición entre los dos sistemas.Específicamente, los monocitos, macrófagos, neutrófilos y células asesinas naturales desempeñan un papel clave en el sistema innato, mientras que los linfocitos y sus subconjuntos desempeñan un papel similar en el sistema inmunológico adaptativo.
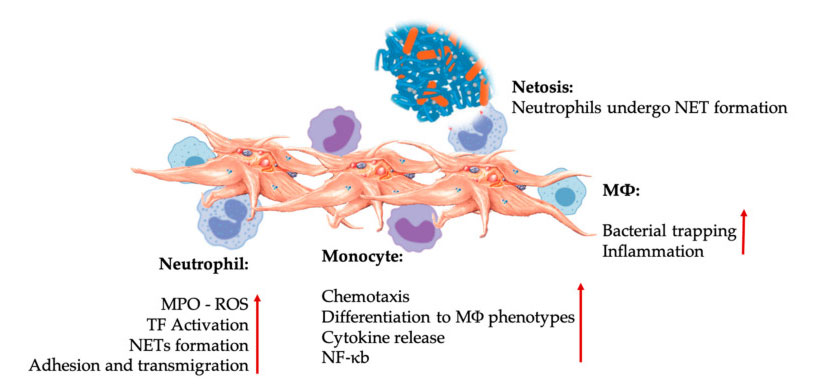
Interacciones de plaquetas y leucocitos en interacciones de células inmunes innatas.Las plaquetas interactúan con los neutrófilos y los monocitos, y finalmente con M Φ interactúan, ajustan y aumentan sus funciones efectoras.Estas interacciones plaquetas-leucocitos provocan inflamación a través de diferentes mecanismos, incluida la NETosis.Abreviaturas: MPO: mieloperoxidasa, ROS: especie reactiva de oxígeno, TF: factor tisular, NET: trampa extracelular de neutrófilos, NF- κ B: factor nuclear kappa B, M Φ: macrófagos.
Sistema inmune innato
La función del sistema inmunológico innato es identificar de forma no específica microorganismos invasivos o fragmentos de tejido y estimular su eliminación.Cuando ciertas estructuras moleculares llamadas receptores de reconocimiento de patrones de expresión superficial (PRR) se combinan con patrones moleculares relacionados con patógenos y patrones moleculares relacionados con daños, el sistema inmunológico innato se activará.Hay muchos tipos de PRR, incluidos el receptor tipo Toll (TLR) y el receptor tipo RIG-1 (RLR).Estos receptores pueden activar el principal factor de transcripción kappa B (NF-κ B). También regula múltiples aspectos de la respuesta inmune innata y adaptativa.Curiosamente, las plaquetas también expresan una variedad de moléculas receptoras inmunorreguladoras en su superficie y citoplasma, como la selectina P, el ligando de la proteína CD40 transmembrana (CD40L), citocinas (como IL-1 β, TGF-β) y TLR específicos de plaquetas. Por tanto, las plaquetas pueden interactuar con diversas células inmunitarias.
Interacción plaquetas-glóbulos blancos en la inmunidad innata
Cuando las plaquetas entran o invaden el flujo sanguíneo o los tejidos, son una de las células que detectan primero la lesión endotelial y los patógenos microbianos.La agregación plaquetaria y promueve la liberación de los agonistas plaquetarios ADP, trombina y vWF, lo que resulta en la activación plaquetaria y la expresión de los receptores de quimiocinas plaquetarias C, CC, CXC y CX3C, provocando así plaquetas en el sitio infectado o lesión.
El sistema inmunológico innato está genéticamente predeterminado para detectar invasores, como virus, bacterias, parásitos y toxinas, o heridas y heridas en los tejidos.Es un sistema no específico, porque cualquier patógeno será identificado como extraño o no propio y localizado rápidamente.El sistema inmunológico innato se basa en un conjunto de proteínas y fagocitos, que reconocen las características bien conservadas de los patógenos y activan rápidamente la respuesta inmune para ayudar a eliminar a los invasores, incluso si el huésped nunca antes ha estado expuesto a patógenos específicos.
Los neutrófilos, los monocitos y las células dendríticas son las células inmunes innatas más comunes en la sangre.Su reclutamiento es necesario para una respuesta inmune temprana adecuada.Cuando el PRP se utiliza en medicina regenerativa, la interacción entre plaquetas y glóbulos blancos regula la inflamación, la cicatrización de heridas y la reparación de tejidos.El TLR-4 en las plaquetas estimula la interacción plaquetas-neutrófilos, que regula el llamado estallido oxidativo de los leucocitos al regular la liberación de especies reactivas de oxígeno (ROS) y mieloperoxidasa (MPO) de los neutrófilos.Además, la interacción entre plaquetas-neutrófilos y la desgranulación de neutrófilos conduce a la formación de trampas extracelulares de neutrófilos (NET).Los NET están compuestos por núcleos de neutrófilos y otros contenidos intracelulares de neutrófilos, que pueden capturar bacterias y matarlas mediante NETosis.La formación de NET es un mecanismo de destrucción esencial de los neutrófilos.
Después de la activación plaquetaria, los monocitos pueden migrar a tejidos enfermos y degenerativos, donde llevan a cabo actividades de adhesión y secretan moléculas inflamatorias que pueden cambiar la quimiotaxis y las propiedades proteolíticas.Además, las plaquetas pueden inducir la activación del NF-κ B de los monocitos para regular la función efectora de los monocitos, que es el mediador clave de la respuesta inflamatoria y de la activación y diferenciación de las células inmunitarias.Las plaquetas promueven aún más el estallido oxidativo endógeno de los monocitos para promover la destrucción de patógenos fagocíticos.La liberación de MPO está mediada por la interacción directa entre plaquetas-monocitos CD40L-MAC-1.Curiosamente, cuando la selectina P activa las plaquetas en condiciones inflamatorias tisulares agudas y crónicas, las quimiocinas derivadas de las plaquetas PF4, RANTES, IL-1 β y CXCL-12 pueden prevenir la apoptosis espontánea de los monocitos, pero promueven su diferenciación en macrófagos.
Sistema inmunológico adaptativo
Después de que el sistema inmunológico innato no específico reconozca el daño microbiano o tisular, el sistema inmunológico adaptativo específico se hará cargo.Los sistemas adaptativos incluyen linfocitos B que se unen a antígenos (células B) y linfocitos T convencionales (Treg) que coordinan la eliminación de patógenos.Las células T se pueden dividir aproximadamente en células T colaboradoras (células Th) y células T citotóxicas (células Tc, también conocidas como células T asesinas).Las células Th se dividen a su vez en células Th1, Th2 y Th17, que tienen funciones clave en la inflamación.Las células Th pueden secretar citocinas proinflamatorias (p. ej., IFN-γ, TNF-β) y varias interleucinas (p. ej., IL-17). Son particularmente eficaces para prevenir infecciones intracelulares virales y bacterianas. Las células Th estimulan la proliferación y diferenciación de las células implicadas en respuesta inmune Las células Tc son células efectoras que pueden eliminar microorganismos y células intracelulares y extracelulares específicos.
Curiosamente, las células Th2 producen IL-4 y afectan la polarización M Φ, la regeneración guiada M Φ fenotipo M Φ 2, mientras que el IFN- γ M Φ cambia al fenotipo inflamatorio M Φ 1, que depende de la dosis y el tiempo de las citocinas.Después de que se activa la IL-4, M Φ 2 induce a las células Treg a diferenciarse en células Th2 y luego produce IL-4 adicional (bucle de retroalimentación positiva).Las células Th convierten M Φ El fenotipo se dirige al fenotipo regenerativo en respuesta a agentes biológicos de origen tisular.Este mecanismo se basa en la evidencia de que las células Th desempeñan un papel importante en el control de la inflamación y la reparación de tejidos.
Interacción plaquetas-glóbulos blancos en la inmunidad adaptativa
El sistema inmunológico adaptativo utiliza receptores específicos de antígenos y recuerda los patógenos encontrados anteriormente y los destruye cuando posteriormente se encuentra con el huésped.Sin embargo, estas respuestas inmunes adaptativas se desarrollaron lentamente.Konias et al.Muestra que el componente plaquetario contribuye a la percepción del riesgo y a la reparación de los tejidos, y que la interacción entre plaquetas y leucocitos promueve la activación de la respuesta inmune adaptativa.
Durante la respuesta inmune adaptativa, las plaquetas promueven respuestas de monocitos y macrófagos a través de la maduración de las células DC y NK, lo que conduce a respuestas específicas de células T y células B.Por lo tanto, los componentes de los gránulos plaquetarios afectan directamente la inmunidad adaptativa al expresar CD40L, una molécula esencial para regular la respuesta inmune adaptativa.Las plaquetas a través del CD40L no sólo desempeñan un papel en la presentación de antígenos, sino que también afectan la reacción de las células T.Liu y cols.Se descubrió que las plaquetas regulan la respuesta de las células T CD4 de forma compleja.Esta regulación diferencial de los subconjuntos de células T CD4 significa que las plaquetas promueven que las células T CD4 respondan a estímulos inflamatorios, produciendo así fuertes respuestas proinflamatorias y antiinflamatorias.
Las plaquetas también regulan la respuesta adaptativa mediada por células B a patógenos microbianos.Es bien sabido que el CD40L en las células T CD4 activadas activará el CD40 de las células B, proporcionando la segunda señal necesaria para la activación de los linfocitos B dependientes de las células T, la posterior conversión de alotipos y la diferenciación y proliferación de las células B.En general, los resultados muestran claramente las diversas funciones de las plaquetas en la inmunidad adaptativa, lo que indica que las plaquetas conectan la interacción entre las células T y las células B a través de CD40-CD40L, mejorando así la respuesta de las células B dependientes de las células T.Además, las plaquetas son ricas en receptores de la superficie celular, que pueden promover la activación plaquetaria y liberar una gran cantidad de moléculas activas inflamatorias y biológicas almacenadas en diferentes partículas plaquetarias, afectando así la respuesta inmune innata y adaptativa.
Papel ampliado de la serotonina derivada de plaquetas en el PRP
La serotonina (5-hidroxitriptamina, 5-HT) tiene un papel clave claro en el sistema nervioso central (SNC), incluida la tolerancia al dolor.Se estima que la mayor parte de la 5-HT humana se produce en el tracto gastrointestinal y luego a través de la circulación sanguínea, donde es absorbida por las plaquetas a través del transportador de recaptación de serotonina y almacenada en partículas densas en altas concentraciones (65 mmol/L).La 5-HT es un conocido neurotransmisor y hormona que ayuda a regular diversos procesos neuropsicológicos en el SNC (5-HT central).Sin embargo, la mayor parte de la 5-HT existe fuera del SNC (5-HT periférica) y participa en la regulación de las funciones biológicas sistémicas y celulares de múltiples sistemas orgánicos, incluidos los sistemas funcionales cardiovascular, pulmonar, gastrointestinal, urogenital y plaquetario.La 5-HT tiene un metabolismo dependiente de la concentración en una variedad de tipos de células, incluidos los adipocitos, las células epiteliales y los glóbulos blancos.El 5-HT periférico también es un poderoso modulador inmunológico, que puede estimular o inhibir la inflamación y afectar varias células inmunes a través de su receptor 5-HT específico (5HTR).
Mecanismo paracrino y autocrino de la HT.
La actividad de 5-HT está mediada por su interacción con 5HTR, que es una superfamilia con siete miembros (5-HT 1 – 7) y al menos 14 subtipos de receptores diferentes, incluido el miembro recientemente descubierto 5-HT 7, su periférico y Función en el manejo del dolor.En el proceso de desgranulación plaquetaria, las plaquetas activadas secretan una gran cantidad de 5-HT derivado de plaquetas, que puede promover la contracción vascular y estimular la activación de plaquetas y linfocitos adyacentes mediante la expresión de 5-HTR en células endoteliales, células del músculo liso y células inmunes.Pacala et al.Se estudió el efecto mitótico de la 5-HT sobre las células endoteliales vasculares y se determinó el potencial de promover el crecimiento de los vasos sanguíneos dañados mediante la estimulación de la angiogénesis.No está del todo claro cómo se regulan estos procesos, pero puede implicar vías diferenciales de señales bidireccionales en el microcircuito tisular para regular las funciones de las células endoteliales vasculares y las células del músculo liso, los fibroblastos y las células inmunitarias a través de receptores 5-HT específicos en estas células. .Se ha descrito la función autocrina de la 5-HT plaquetaria tras la activación plaquetaria [REF].La liberación de 5-HT mejora la activación de las plaquetas y el reclutamiento de plaquetas circulantes, lo que lleva a la activación de reacciones en cascada de señales y efectores ascendentes que apoyan la reactividad plaquetaria.
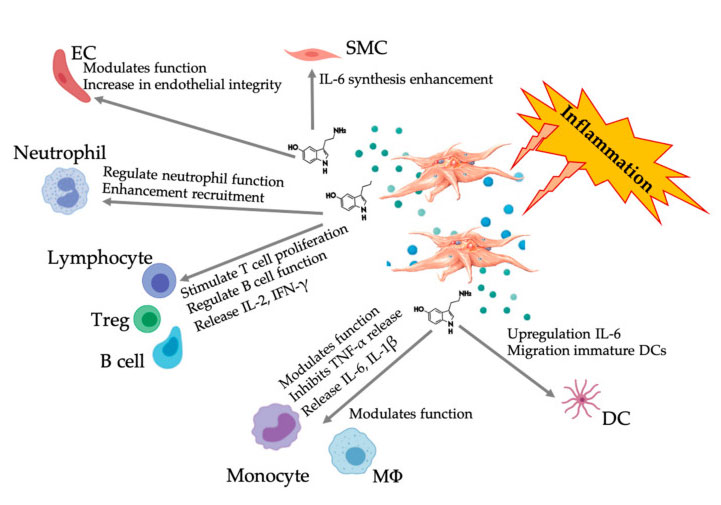
Efecto inmunomodulador 5-HT
Cada vez hay más evidencia que muestra que la serotonina puede desempeñar un papel en diferentes 5HTR como modulador inmunológico.Según el 5HTR expresado en varios leucocitos implicados en la reacción inflamatoria, el 5-HT derivado de plaquetas actúa como un regulador inmunológico tanto en el sistema inmunológico innato como en el adaptativo.5-HT puede estimular la proliferación de Treg y regular las funciones de las células B, las células asesinas naturales y los neutrófilos mediante el reclutamiento de DC y monocitos en el sitio inflamatorio.Estudios recientes han demostrado que la 5-HT derivada de plaquetas puede regular la función de las células inmunitarias en condiciones específicas.Por lo tanto, al utilizar C-PRP, una concentración de plaquetas superior a 1 × 10 6/μ L puede ayudar significativamente a transportar la concentración de 5-HT derivada de plaquetas grandes al tejido.En el microambiente caracterizado por componentes inflamatorios, el PRP puede interactuar con varias células inmunes que desempeñan un papel clave en estas patologías, lo que puede afectar los resultados clínicos.
Figura que muestra la respuesta multifacética de 5-HT después de la activación de plaquetas inflamatorias de PRP.Después de la activación de las plaquetas, las plaquetas liberan sus gránulos, incluido el 5-HT en gránulos densos, que tiene una amplia gama de efectos diferenciales sobre diversas células inmunitarias, células endoteliales y células del músculo liso.Abreviaturas: SMC: células de músculo liso, EC: células endoteliales, Treg: linfocitos T convencionales, M Φ: macrófagos, DC: células dendríticas, IL: interleucina, IFN-γ: interferón γ. Modificado y adaptado de Everts et al.y Hull et al.
Efecto analgésico del PRP
Las plaquetas activadas liberarán muchos mediadores proinflamatorios y antiinflamatorios, que no sólo pueden causar dolor, sino también reducir la inflamación y el dolor.Una vez aplicada, la dinámica plaquetaria típica del PRP cambia el microambiente antes de la reparación y regeneración del tejido a través de una variedad de vías complejas relacionadas con el anabolismo y el catabolismo, la proliferación celular, la diferenciación y la regulación de las células madre.Estas características del PRP conducen a la aplicación del PRP en diversas condiciones clínicas patológicas generalmente asociadas con dolor crónico (como lesiones deportivas, enfermedades ortopédicas, enfermedades de la columna y heridas crónicas complejas), aunque el mecanismo exacto no se ha determinado completamente.
En 2008, Evertz et al.Es el primer ensayo controlado aleatorio que informa el efecto analgésico de la preparación de PRP, que se prepara a partir de la capa marrón de la velocidad de sedimentación globular autóloga y se activa con trombina autóloga después de una cirugía de hombro.Observaron una reducción significativa en las puntuaciones de la escala visual analógica, el uso de analgésicos a base de opioides y una rehabilitación postoperatoria más exitosa.Es de destacar que reflejan el efecto analgésico de las plaquetas activadas y especulan sobre el mecanismo por el que las plaquetas liberan 5-HT.En resumen, las plaquetas están inactivas en el PRP recién preparado.Después de la activación de las plaquetas directa o indirectamente (factor tisular), las plaquetas cambian de forma y producen cantidades suficientes de plaquetas para promover la agregación plaquetaria.Luego, liberan partículas α-Y densas intracelulares.El tejido tratado con PRP activado será invadido por PGF, citoquinas y otros lisosomas plaquetarios.Más concretamente, cuando las partículas densas liberan su contenido, liberarán una gran cantidad de 5-HT que regula el dolor.En C-PRP, la concentración de plaquetas es de 5 a 7 veces mayor que la de la sangre periférica.Por tanto, la liberación de 5-HT de las plaquetas es astronómica.Curiosamente, Sprott et al.El informe observó que el dolor se alivió significativamente después de la acupuntura y la moxibustión, la concentración de 5-HT derivada de plaquetas se redujo significativamente y luego se aumentó el nivel plasmático de 5-HT.
En el periférico, las plaquetas, los mastocitos y las células endoteliales liberarán 5-HT endógeno durante una lesión tisular o un traumatismo quirúrgico.Curiosamente, se detectaron diversos receptores de neuronas 5-HT en el área periférica, lo que confirmó que el 5-HT puede interferir con la transmisión nociceptiva en el área periférica.Estos estudios muestran que el 5-HT puede afectar la transmisión nociceptiva de los tejidos periféricos a través de los receptores 5-HT1, 5-HT2, 5-HT3, 5-HT4 y 5-HT7.
El sistema 5-HT representa un poderoso sistema que puede reducir y aumentar el grado de dolor después de una estimulación dañina.En pacientes con dolor crónico se ha informado sobre la regulación central y periférica de las señales nociceptivas y los cambios en el sistema 5-HT.En los últimos años, un gran número de estudios se han centrado en el papel de la 5-HT y sus respectivos receptores en el procesamiento y regulación de la información nociva, dando lugar a fármacos como los inhibidores selectivos de la recaptación de serotonina (ISRS).Este fármaco inhibe la recaptación de serotonina en las neuronas presinápticas después de la liberación de serotonina.Afecta la duración y la intensidad de la comunicación de la serotonina y es un tratamiento alternativo para el dolor crónico.Se necesita más investigación clínica para comprender claramente el mecanismo molecular de la regulación del dolor 5-HT derivado del PRP en enfermedades crónicas y degenerativas.
Se pueden obtener otros datos para resolver el posible efecto analgésico del PRP después de la prueba del modelo animal analgésico.Las conclusiones estadísticas comparativas de estos modelos son desafiantes porque estos estudios contienen demasiadas variables.Sin embargo, algunos estudios clínicos han abordado los efectos nociceptivos y analgésicos del PRP.Varios estudios han demostrado que los pacientes que reciben tratamiento para la tendinosis o los desgarros del manguito rotador experimentan poco alivio del dolor.Por el contrario, varios otros estudios han demostrado que el PRP puede reducir o incluso eliminar el dolor de pacientes con degeneración de tendones, OA, fascitis plantar y otras enfermedades de pies y tobillos.La concentración final de plaquetas y la composición biológica de las células se han identificado como las características clave del PRP, que ayudan a observar el efecto analgésico constante después de la aplicación del PRP.Otras variables incluyen el método de administración de PRP, la tecnología de aplicación, el protocolo de activación plaquetaria, el nivel de actividad biológica de PGF y las citoquinas liberadas, el tipo de tejido de aplicación de PRP y el tipo de lesión.
Es de destacar que Kuffler resolvió el potencial del PRP para aliviar el dolor en pacientes con dolor neuropático crónico de leve a severo, secundario al nervio no regenerativo dañado.El propósito de este estudio es investigar si el dolor neuropático se puede reducir o disminuir debido al PRP que promueve la regeneración axonal y la reinervación del nervio diana.Sorprendentemente, entre los pacientes que reciben tratamiento, el dolor neuropático todavía se elimina o alivia al menos seis años después de la cirugía.Además, todos los pacientes comenzaron a aliviar el dolor dentro de las tres semanas posteriores a la aplicación del PRP.
Recientemente, se han observado efectos analgésicos similares del PRP en el campo del cuidado posoperatorio de heridas y piel.Curiosamente, los autores informaron sobre los aspectos fisiológicos del dolor de la herida asociado con la lesión vascular y la hipoxia del tejido cutáneo.También discutieron la importancia de la angiogénesis para optimizar la oxigenación y el suministro de nutrientes.Su estudio demostró que, en comparación con el grupo de control, los pacientes que recibieron tratamiento con PRP tuvieron menos dolor y una angiogénesis significativamente mayor.Finalmente, Johal y sus colegas llevaron a cabo una revisión sistemática y un metanálisis y concluyeron que el PRP puede reducir el dolor después de usarlo en indicaciones ortopédicas, especialmente en pacientes que reciben tratamiento de epicondilitis externa y OA de rodilla.Desafortunadamente, este estudio no especificó los efectos de los glóbulos blancos, la concentración de plaquetas o el uso de activadores plaquetarios exógenos, porque estas variables afectarían la efectividad general del PRP.No está clara la concentración óptima de plaquetas de PRP para el máximo alivio del dolor.En el modelo de tendinosis en ratas, la concentración de plaquetas fue de 1,0 × 10 6 / μ. En L, el dolor puede aliviarse por completo, mientras que el alivio del dolor causado por el PRP con la mitad de la concentración de plaquetas se reduce significativamente.Por lo tanto, recomendamos realizar más estudios clínicos para investigar los efectos analgésicos de diferentes preparaciones de PRP.
Efecto PRP y angiogénesis.
Las preparaciones de C-PRP en medicina regenerativa precisa permiten la administración de biomoléculas liberadas por altas concentraciones de plaquetas activadas en los sitios del tejido objetivo.Por lo tanto, se han iniciado una variedad de reacciones en cascada que contribuyen a la regulación inmune in situ, el proceso inflamatorio y la angiogénesis para promover la curación y la reparación de tejidos.
La angiogénesis es un proceso dinámico de varios pasos que involucra la germinación y los microvasos tisulares de vasos sanguíneos preexistentes.La angiogénesis ha progresado debido a una variedad de mecanismos biológicos, incluida la migración, proliferación, diferenciación y división de las células endoteliales.Estos procesos celulares son requisitos previos para la formación de nuevos vasos sanguíneos.Son esenciales para el crecimiento de vasos sanguíneos preexistentes para restaurar el flujo sanguíneo y apoyar la alta actividad metabólica de reparación y regeneración de tejidos.Estos nuevos vasos sanguíneos permiten el suministro de oxígeno y nutrientes y la eliminación de subproductos de los tejidos tratados.
La actividad de la angiogénesis está regulada por la estimulación del factor angiogénico VEGF y factores antiangiogénicos (p. ej., angiostatina y trombospondina-1 [TSP-1]).En el microambiente enfermo y degradado (que incluye baja tensión de oxígeno, bajo pH y alto nivel de ácido láctico), los factores angiogénicos locales restaurarán la actividad de la angiogénesis.
Varios medios solubles en plaquetas, como el FGF básico, el TGF-β y el VEGF, pueden estimular las células endoteliales para que produzcan nuevos vasos sanguíneos.Landsdown y Fortier informaron varios resultados relacionados con la composición del PRP, incluidas las fuentes intraplaquetarias de muchos reguladores angiogénicos.Además, concluyeron que el aumento de la angiogénesis contribuye a la curación de la enfermedad MSK en áreas con mala vascularización, como desgarro de menisco, lesión de tendón y otras áreas con mala vascularización.
Propiedades plaquetarias promotoras y antiangiogénicas.
En las últimas décadas, estudios publicados han demostrado que las plaquetas desempeñan un papel clave en la hemostasia primaria, la formación de coágulos, la liberación de factores de crecimiento y citocinas y la regulación de la angiogénesis como parte del proceso de reparación de tejidos.Paradójicamente, los gránulos de PRP α contienen un arsenal de factores de crecimiento proangiogénicos, proteínas antiangiogénicas y citocinas (como PF4, inhibidor del activador del plasminógeno-1 y TSP-1) y apuntan a la liberación de factores específicos que desempeñan un papel. .Papel en la angiogénesis.Por lo tanto, el papel del PRP en el control de la regulación de la angiogénesis puede definirse mediante la activación de receptores específicos de la superficie celular, el TGF-β, que inicia reacciones proangiogénicas y antiangiogénicas.La capacidad de las plaquetas para ejercer la vía de la angiogénesis se ha confirmado en la angiogénesis patológica y en la angiogénesis tumoral.
Factor de crecimiento angiogénico derivado de plaquetas y factor de crecimiento antiangiogénico, derivado de moléculas α-Y densas y adhesivas.Lo más importante es que generalmente se acepta que el efecto general de las plaquetas sobre la angiogénesis es proangiogénico y estimulante.Se espera que la terapia con PRP controle la inducción de la angiogénesis, lo que contribuirá al efecto del tratamiento de muchas enfermedades, como la cicatrización de heridas y la reparación de tejidos.La administración de PRP, más específicamente la administración de PGF en alta concentración y otras citocinas plaquetarias, puede inducir angiogénesis, angiogénesis y arteriogénesis, porque el factor 1a derivado de células estromales se une al receptor CXCR4 en las células progenitoras endoteliales.Bill y cols.Se sugiere que el PRP aumenta la neovascularización isquémica, lo que puede deberse a la estimulación de la angiogénesis, la angiogénesis y la arteriogénesis.En su modelo in vitro, la proliferación de células endoteliales y la formación de capilares fueron inducidas por un gran número de PDG diferentes, de los cuales el VEGF era el principal estimulador angiogénico.Otro factor importante y esencial para restaurar la vía de angiogénesis es la sinergia entre múltiples PGF.Richardson y cols.Se demostró que la actividad sinérgica del factor angiogénico de crecimiento derivado de plaquetas bb (PDGF-BB) y VEGF condujo a la rápida formación de una red vascular madura en comparación con la actividad del factor de crecimiento individual.El efecto combinado de estos factores se confirmó recientemente en un estudio sobre la mejora de la circulación colateral cerebral en ratones con hipoperfusión prolongada.
Lo más importante es que un estudio in vitro midió el efecto proliferativo de las células endoteliales de la vena umbilical humana y diversas concentraciones de plaquetas en la selección del dispositivo de preparación de PRP y la estrategia de dosis de plaquetas, y los resultados mostraron que la dosis óptima de plaquetas era 1,5 × 10 6 plaquetas/μ. 50. Para promover la angiogénesis.Una concentración demasiado alta de plaquetas puede inhibir el proceso de angiogénesis, por lo que el efecto es deficiente.
Envejecimiento celular, envejecimiento y PRP
La senescencia celular puede ser inducida por diversos estímulos.Este es un proceso en el que las células dejan de dividirse y sufren cambios fenotípicos únicos para prevenir el crecimiento irrestricto de células dañadas, lo que juega un papel importante en la prevención del cáncer.En el proceso de envejecimiento fisiológico, el envejecimiento de la replicación celular también promoverá el envejecimiento celular y se reducirá la capacidad de regeneración de las MSC.
Efectos del envejecimiento y envejecimiento celular
In vivo, muchos tipos de células envejecerán y se acumularán en varios tejidos durante el envejecimiento, entre los cuales hay una gran cantidad de células envejecidas.La acumulación de células envejecidas parece aumentar con el aumento de la edad, el daño del sistema inmunológico, el daño tisular o los factores relacionados con el estrés.El mecanismo del envejecimiento celular ha sido identificado como el factor patogénico de enfermedades relacionadas con la edad, como la osteoartritis, la osteoporosis y la degeneración del disco intervertebral.Una variedad de estímulos agravarán el envejecimiento celular.En respuesta, el fenotipo secretor relacionado con la senescencia (SASP) secretará altas concentraciones de células proteicas y citoquinas.Este fenotipo especial está relacionado con el envejecimiento de las células, en las que secretan altos niveles de citoquinas inflamatorias (como IL-1, IL-6, IL-8), factores de crecimiento (como TGF-β, HGF, VEGF, PDGF), MMP y catepsina.En comparación con los jóvenes, se ha demostrado que el SAPS aumenta con la edad, porque el proceso de estado estacionario se destruye, lo que resulta en envejecimiento celular y reducción de la capacidad de regeneración.En concreto, en enfermedades de las articulaciones y enfermedades del músculo esquelético.En este sentido, se considera que el envejecimiento inmunológico es un cambio significativo en el espectro de secreción de las células inmunes, lo que indica que la concentración de TNF-a, IL-6 y/o Il-1b aumenta, lo que conduce a una inflamación crónica de bajo grado.Vale la pena señalar que la disfunción de las células madre también está relacionada con mecanismos autónomos no celulares, como el envejecimiento de las células, especialmente la producción de factores proinflamatorios y antiregenerativos a través de SASP.
Por el contrario, SASP también puede estimular la plasticidad celular y la reprogramación de células adyacentes.Además, SASP puede organizar la comunicación con varios mediadores inmunitarios y activar las células inmunitarias para promover la eliminación de las células envejecidas.Comprender el papel y la función de las células envejecidas contribuirá a la curación y remodelación de los tejidos de los músculos MSK y las heridas crónicas.
Es de destacar que Ritcka et al.Se llevó a cabo un estudio extenso y se descubrió el papel principal y beneficioso de SASP en la promoción de la plasticidad celular y la regeneración de tejidos, y se introdujo el concepto de administración de tratamiento transitorio de células envejecidas.Mencionaron con cautela que el envejecimiento es principalmente un proceso beneficioso y regenerativo.
Envejecimiento celular y potencial del PRP.
A medida que disminuye la cantidad de células madre, el envejecimiento afectará el rendimiento de las células madre.De manera similar, en los humanos, las características de las células madre (como la sequedad, la proliferación y la diferenciación) también disminuyen con la edad.Wang y Nirmala informaron que el envejecimiento reduciría las características de las células madre de las células tendinosas y la cantidad de receptores del factor de crecimiento.Un estudio en animales demostró que la concentración de PDGF en caballos jóvenes era alta.Concluyeron que el aumento en la cantidad de receptores de GF y la cantidad de GF en individuos jóvenes puede tener una mejor respuesta celular al tratamiento con PRP que los individuos mayores en individuos jóvenes.Estos hallazgos revelan por qué el tratamiento con PRP puede ser menos eficaz o incluso ineficaz en pacientes de edad avanzada con menos células madre y de “mala calidad”.Se ha demostrado que el proceso de envejecimiento del cartílago envejecido se revierte y el período de reposo de los condrocitos aumenta después de la inyección de PRP.Jia et al.Se utiliza para estudiar el fotoenvejecimiento in vitro de fibroblastos dérmicos de ratón, con y sin tratamiento con PRP, para aclarar el mecanismo de contrarrestación del PGF en este modelo.El grupo PRP mostró un efecto directo sobre la matriz extracelular, aumentó el colágeno tipo I y disminuyó la síntesis de metaloproteinasas, lo que indica que el PRP puede contrarrestar el envejecimiento celular y también en la enfermedad degenerativa MSK.
En otro estudio, se utilizó PRP para recolectar células madre envejecidas de la médula ósea de ratones ancianos.Se ha determinado que el PRP puede recuperar una variedad de funciones de las células madre del envejecimiento, como la proliferación celular y la formación de colonias, y reconstruir los marcadores relacionados con el envejecimiento celular.
Recientemente, Oberlohr y sus colegas estudiaron exhaustivamente el papel del envejecimiento celular en el debilitamiento de la regeneración muscular y evaluaron el PRP y el plasma pobre en plaquetas (PPP) como opciones de tratamiento biológico para la reparación del músculo esquelético.Imaginaron que el tratamiento con PRP o PPP para la reparación del músculo esquelético se basaría en factores biológicos personalizados para marcadores celulares específicos de SASP y otros factores que conducen al desarrollo de fibrosis.
Es razonable creer que antes de la aplicación de PRP, el envejecimiento celular específico puede mejorar las características de regeneración de la eficacia del tratamiento biológico al reducir los factores SASP locales.Se ha sugerido que otra opción para mejorar los resultados del tratamiento con PRP y PPP para la regeneración del músculo esquelético es eliminar selectivamente las células envejecidas con eliminadores del envejecimiento.No hay duda de que los resultados de las investigaciones recientes sobre el efecto del PRP sobre el envejecimiento y el envejecimiento celular son fascinantes, pero aún se encuentran en la etapa inicial.Por lo tanto, no es razonable hacer sugerencias en este momento.
(El contenido de este artículo se reimprime y no ofrecemos ninguna garantía expresa o implícita sobre la exactitud, confiabilidad o integridad del contenido de este artículo, y no somos responsables de las opiniones de este artículo, por favor comprenda).
Hora de publicación: 01-mar-2023