El papel de las plaquetas en el concentrado de aspiración de médula ósea.
El PRP y el concentrado de aspiración de médula ósea (BMAC) se utilizan para una serie de tratamientos clínicos en consultorios y cirugía debido a sus beneficios regenerativos en MSK y enfermedades de la columna, manejo del dolor crónico e indicaciones de tejidos blandos.El PRP no solo regula la migración y proliferación celular, sino que también contribuye a la angiogénesis y la remodelación de la ECM para crear un microambiente favorable y promover la reparación y regeneración de tejidos.
Proceso de reparación de BMAC
Las BMAC son composiciones celulares heterogéneas que contienen BMMSC, lo que las convierte en una fuente de células endógenas para la terapia de reparación de medicina regenerativa.Desempeñan un papel al reducir la apoptosis celular, la fibrosis y la inflamación;Y active la reacción en cascada que conduce a la proliferación celular.Además, las BMMSC tienen el potencial de diferenciarse en una variedad de linajes celulares, incluidos osteoblastos, adipocitos, mioblastos, células epiteliales y neuronas.También promueven la angiogénesis a través de vías paracrinas y autocrinas.También es importante que BMMSC contribuya a la regulación inmune independientemente de las células inmunes específicas, que participan en la etapa inflamatoria de la reparación de heridas.Además, las BMMSC apoyan el reclutamiento de células en nuevos sitios de tratamiento de angiogénesis para acelerar la reconstrucción del flujo sanguíneo local.Jin et al.Se demostró que, en ausencia de andamios suficientes, la tasa de supervivencia de BMMSC y su capacidad de reparación y diferenciación para promover la curación se vieron dañadas.Aunque la recolección de tejido, la preparación de muestras y el mecanismo de acción de PRP y BMAC son diferentes, los estudios muestran que pueden complementarse entre sí.De hecho, combinar PRP y BMAC en un producto biológico puede tener ventajas adicionales.
Combinando PRP y BMAC
Según algunas investigaciones poco conocidas, el principio básico de combinar PRP y BMAC se basa en varias premisas.En primer lugar, el PRP puede proporcionar un microambiente adecuado en el que las BMSC pueden mejorar la proliferación y diferenciación celular y aumentar la angiogénesis.En segundo lugar, el PRP se ha utilizado como andamio para estas células junto con BMAC.Por el contrario, la combinación de PRP y BMAC puede convertirse en una poderosa herramienta biológica para atraer población de BMMSC.El compuesto PRP-BMAC se ha utilizado para tratar tendinosis, heridas, lesiones de la médula espinal, discos intervertebrales degenerativos y defectos osteocondrales con gran potencial de regeneración.Desafortunadamente, aunque los componentes celulares heterogéneos de la médula ósea incluyen plaquetas, pocos informes mencionan la concentración de plaquetas en la médula ósea extraída y después del tratamiento con BMAC, pero pueden extraerse mediante métodos de aspiración adecuados.Se necesita más investigación para comprender si es necesario utilizar concentrados de plaquetas adicionales en combinación con BMAC.Actualmente, no hay datos sobre la proporción óptima de plaquetas y células MSC (u otras células de la médula ósea), lo que tiene un impacto positivo en el mecanismo nutricional de las MSC en la reparación de tejidos.Idealmente, el equipo y la tecnología de recolección de médula ósea se pueden optimizar para extraer suficientes plaquetas de la médula ósea.
Factor de crecimiento PRP y efecto nutricional de BMAC.
El factor de crecimiento plaquetario PRP es una proteína clave involucrada en el proceso de reparación de BMAC.La diversidad de PGF y otras citoquinas involucradas en el proceso nutricional de BMAC puede iniciar la reparación de tejidos al reducir la apoptosis celular, el anabolismo y los efectos antiinflamatorios, y activar la proliferación, diferenciación y angiogénesis celular a través de vías paracrinas y autocrinas.
El factor de crecimiento derivado de plaquetas y los componentes de gránulos densos obviamente participan en el proceso nutricional de BMAC y apoyan la reparación y regeneración de tejidos inducida por MSC.Abreviaturas: MSC: células madre mesenquimales, HSC: células madre hematopoyéticas.
Obviamente, en el tratamiento de la OA, el PDGF desempeña un papel específico en la regeneración del cartílago y el mantenimiento de la homeostasis mediante la proliferación de MSC y la inhibición de la apoptosis y la inflamación de los condrocitos inducida por IL-1.Además, tres subtipos de TGF-β son activos para estimular la formación de cartílago e inhibir la inflamación, y muestran la capacidad de promover la curación de tejidos relacionados con MSC a través de la interacción intermolecular.El efecto nutricional de las MSC está relacionado con la actividad de la PGF y la secreción de citocinas reparadoras.Idealmente, todas estas citocinas deberían estar presentes en el frasco de tratamiento de BMAC y transportarse al sitio de la lesión tisular para promover la mejor curación terapéutica del tejido relacionada con las MSC.
En un estudio conjunto de OA, Mui ñ os-L ó pez et al.Muestra que las MSC derivadas del tejido sinovial han cambiado de función, lo que resulta en la pérdida de su capacidad de recuperación.Curiosamente, la inyección directa de PRP en el hueso subcondral de la osteoartritis dio como resultado la reducción de MSC en el líquido sinovial, lo que indica una mejoría clínica.El efecto terapéutico está mediado por la reducción del proceso inflamatorio en el líquido sinovial de los pacientes con OA.
Hay poca información disponible sobre la presencia o concentración de PGF en BMAC o la proporción ideal requerida para respaldar la función nutricional de BMMSC.Algunos médicos combinan una alta concentración de PRP con BMAC para obtener injertos más biológicamente activos, lo que se espera que optimice los resultados del tratamiento de la medicina regenerativa.Sin embargo, hay pocos datos disponibles sobre seguridad y eficacia, lo que indica que combinar una alta concentración de PRP con BMAC es una opción de tratamiento más eficaz.Por lo tanto, creemos que puede no ser apropiado manipular BMMSC activándolos con una alta concentración de plaquetas en esta etapa.
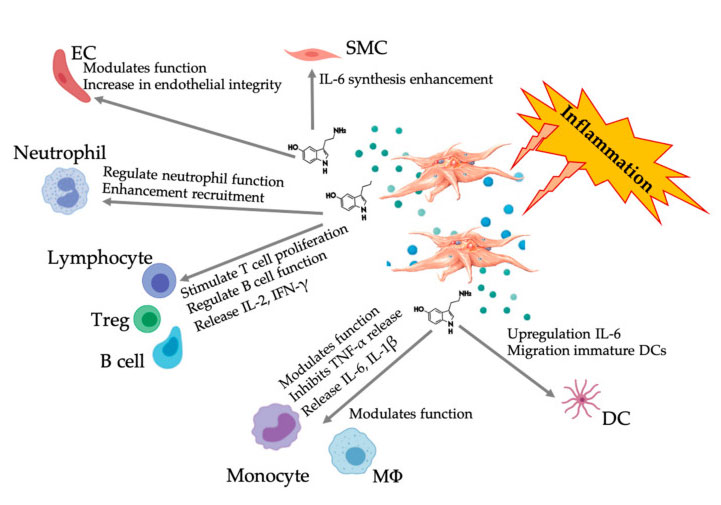
Interacción de plaquetas con fármacos antiplaquetarios y AINE.
El PRP contiene un amplio espectro de componentes secretores y está compuesto de muchos medios biológicos.El efecto terapéutico del PRP se atribuye a estos mediadores.Aunque los mediadores terapéuticos de las plaquetas son bien conocidos, la formulación óptima y la cinética de estos fármacos anabólicos y catabólicos no están completamente claras.Una de las principales limitaciones para lograr formulaciones terapéuticas es superar la variabilidad de estos mediadores biológicos para apuntar a efectos posteriores bien regulados que siempre sean repetibles y clínicamente beneficiosos.Por esta razón, los medicamentos (como los antiinflamatorios no esteroides (AINE)) pueden afectar la liberación de grupos secretores de plaquetas.En un reciente estudio abierto de secuencia fija, la ingesta diaria de 81 mg de aspirina (AAS) redujo la expresión de mediadores clave, como TGF-β 1, PDGF y VEGF.
Estos efectos se atribuyen a la inhibición irreversible de la ciclooxigenasa-1 (COX-1) y la inhibición ajustable de la ciclooxigenasa-2 (COX-2), que son dos enzimas necesarias para la desgranulación plaquetaria posterior.Una revisión sistemática reciente encontró que los medicamentos antiplaquetarios pueden reducir la curva de liberación del factor de crecimiento de manera dependiente de la COX-1 y la COX-2, y 8 de los 15 estudios encontraron que los factores de crecimiento disminuyeron.
Los medicamentos (por ejemplo, AINE) generalmente se usan para aliviar el dolor y reducir la inflamación causada por la enfermedad MSK.El mecanismo de los AINE es inhibir la activación plaquetaria uniéndose irreversiblemente a la enzima COX y regulando la vía del ácido araquidónico.Por lo tanto, la función de las plaquetas cambiará durante todo el ciclo de vida de las plaquetas, impidiendo así la transmisión de la señal de PGF.Los AINE inhiben la producción de citoquinas (p. ej., PDGF, FGF, VEGF e IL-1 β, IL-6 e IL-8), al tiempo que mejoran el TNF- α. Sin embargo, hay pocos datos sobre el impacto molecular de los AINE en el PRP.No existe consenso sobre el mejor momento para la preparación y administración de PRP en pacientes que utilizan AINE.Mannava y sus colegas cuantificaron los factores biológicos anabólicos y catabólicos en el PRP rico en leucocitos de voluntarios sanos que tomaban naproxeno.Descubrieron que después de usar naproxeno durante una semana, los niveles de PDGF-AA y PDGF-AB (mitógeno eficaz para promover la angiogénesis) se redujeron significativamente.Después de una semana, el nivel del factor de crecimiento volvió a acercarse al nivel inicial.Después de usar naproxeno durante una semana, el nivel de LR-PRP del factor catabólico e inflamatorio IL-6 también disminuyó y volvió al nivel inicial después de un período de eliminación de una semana.En la actualidad, no existe ningún estudio clínico que demuestre que los pacientes con naproxeno después del tratamiento con PRP tengan resultados negativos;Sin embargo, se recomienda considerar un período de lavado de una semana para restaurar los valores de PDGF-AA, PDGF-BB e IL-6 al nivel inicial para mejorar su actividad biológica.Se necesita más investigación para comprender completamente los efectos de los antiplaquetarios y los AINE sobre el grupo de secreción de PRP y sus objetivos posteriores.
Combinar la aplicación de plasma rico en plaquetas con la rehabilitación
Aunque la investigación científica básica muestra que la fisioterapia y la carga mecánica tienen un papel claro en la recuperación de la estructura del tendón después de la inyección de PRP, no existe consenso sobre el mejor plan de rehabilitación para la enfermedad MSK después del tratamiento con PRP.
El tratamiento con PRP incluye la inyección de plaquetas concentradas en el entorno del tejido local para regular el dolor y promover la reparación del tejido.La evidencia clínica más sólida existe en la OA de rodilla.Sin embargo, el uso de PRP en el tratamiento de la tendinosis sintomática es controvertido y los resultados informados son diferentes.Los estudios en animales suelen mostrar una mejoría histológica de la tendinosis después de la infiltración de PRP.Estos estudios muestran que la carga mecánica puede regenerar los tendones, y la carga y la inyección de PRP trabajan juntas para promover la curación del tendón.Las diferencias en las preparaciones de PRP, las preparaciones biológicas, las preparaciones, los esquemas de inyección y los subtipos de lesiones del tendón pueden dar lugar a diferencias en los resultados clínicos.Además, aunque la evidencia científica respalda los beneficios de los planes de rehabilitación, pocas investigaciones clínicas publicadas intentan gestionar e integrar planes de rehabilitación post-PRP consistentes.
Recientemente, Onishi et al.Se revisó el papel de la carga mecánica y el efecto biológico del PRP en la enfermedad del tendón de Aquiles.Evaluaron los estudios clínicos de fase I y fase II de la enfermedad del tendón de Aquiles tratada con PRP, centrándose en el plan de rehabilitación después de la inyección de PRP.Los programas de rehabilitación supervisados parecen mejorar el cumplimiento del ejercicio y mejorar los resultados y la capacidad de controlar la dosis de ejercicio.Varios ensayos de PRP del tendón de Aquiles bien diseñados combinaron el tratamiento post-PRP con un plan de rehabilitación de carga mecánica como parte integral de la estrategia de regeneración.
Perspectivas de futuro y conclusiones
El progreso técnico de los equipos y métodos de preparación de PRP muestra resultados prometedores para los pacientes, aunque la definición de los diferentes agentes biológicos de PRP y las características biológicas relevantes del producto final aún no son concluyentes.Además, no se ha determinado todo el potencial de las indicaciones y aplicaciones del PRP.Hasta hace poco, el PRP se ha vendido comercialmente como un producto derivado de la sangre autólogo, que puede brindar a los médicos la capacidad de utilizar la tecnología del factor de crecimiento plaquetario autólogo en patologías y enfermedades específicas indicadas.Al principio, el único criterio que se cita a menudo para una aplicación exitosa del PRP es la muestra preparada, cuya concentración de plaquetas es mayor que el valor de sangre total.Hoy, afortunadamente, los profesionales tienen una comprensión más completa del funcionamiento del PRP.
En esta revisión reconocemos que aún falta estandarización y clasificación en la tecnología de preparación;Por lo tanto, actualmente no existe consenso sobre los agentes biológicos de PRP, aunque más literatura ha llegado a un acuerdo sobre la concentración de dosis de plaquetas efectiva requerida para promover (nueva) angiogénesis.Aquí, introdujimos brevemente la actividad de las PGF, pero reflejamos de manera más amplia el mecanismo plaquetario específico y el efecto efector de los glóbulos blancos y las MSC, así como la posterior interacción célula-célula.En particular, la presencia de glóbulos blancos en las preparaciones de PRP proporciona una comprensión más profunda de los efectos nocivos o beneficiosos.Se ha discutido el papel claro de las plaquetas y su interacción con los sistemas inmunológicos innato y adaptativo.Además, se necesitan estudios clínicos suficientes y bien documentados para determinar todo el potencial y efecto terapéutico del PRP en diversas indicaciones.
(El contenido de este artículo se reimprime y no ofrecemos ninguna garantía expresa o implícita sobre la exactitud, confiabilidad o integridad del contenido de este artículo, y no somos responsables de las opiniones de este artículo, por favor comprenda).
Hora de publicación: 01-mar-2023